【当講座の研究内容】
1.恒常性維持や疾患発症に関わる組織内微小環境因子代謝研究
Modulation of tissue microenvironmental factors under pathophysiological conditions
私たちの体は細胞と細胞間物質から構成されており、細胞の機能は細胞外マトリックスや生理活性物質からなる細胞間組織内微小環境因子によって規定されています。これらの組織内微小環境因子は、正常組織では恒常性維持に働く一方で、病的状態ではプロテアーゼなどの酵素により分解され、組織の破壊・再生に関与することが知られています。我々は主にMMP(Matrix metalloproteinase)やADAM(A disintegrin and metalloproteinase)といったメタロプロテアーゼに着目し、がんをはじめとするさまざまな疾患の発症・進展機序の解析を行っています。MMPは1960年代にオタマジャクシの尾が吸収される過程に関わる酵素として発見され、その後がんやリウマチなどさまざまな疾患での組織破壊に関与していることがわかっています。一方、ADAMは蛇毒メタロプロテアーゼに類似したMMP近縁遺伝子ファミリーで、MMPと同様に細胞外マトリックスや生理活性物質の代謝に関わるほか、膜タンパクのsheddingにおいても重要な役割を果たすことが知られています。
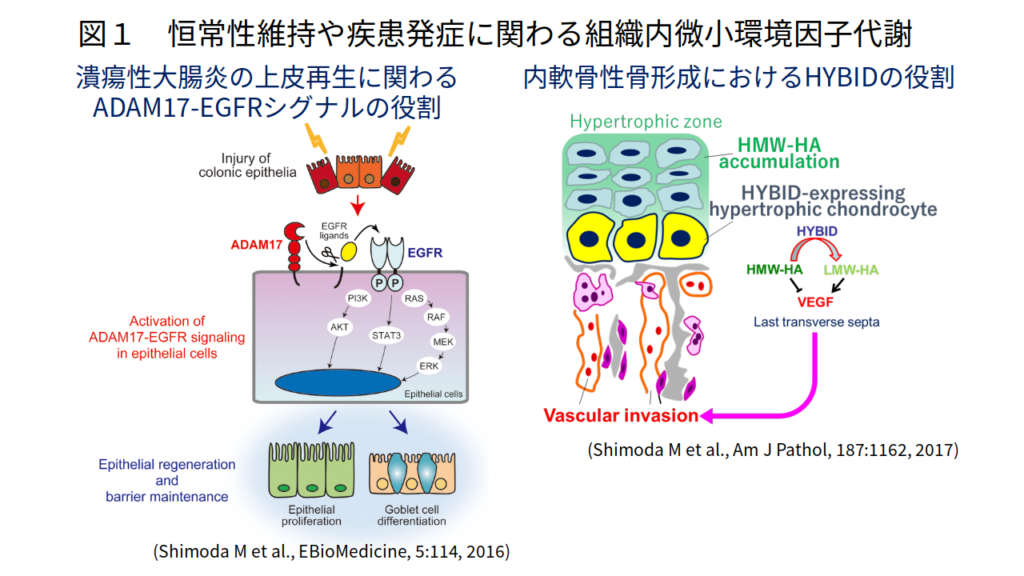
我々はこれまでに、ADAM28がヒトがん細胞選択的に高発現し、がん細胞の増殖・転移と有意に相関することを示すとともに(Int J Cancer, 118:263, 2006; Cancer Res, 66:9913, 2006)、細胞接着・運動・浸潤能促進、抗アポトーシス作用、血管新生などを介して(J Biol Chem, 282:25864, 2007; J Natl Cancer Inst, 104:906, 2012)、がん進展を促進することを明らかにしてきました。さらに、急性大動脈解離や大動脈瘤形成におけるMMP-9やADAM17の作用機構(Atherosclerosis, 218:470, 2011; Circulation, 126:3070, 2012; Circ Res, 116:612, 2015)、筋再生におけるADAM10の役割(J Biol Chem, 290:28456, 2015)、潰瘍性大腸炎の上皮再生に関わるADAM17-EGFRシグナルの役割(EBioMedicine, 5:114, 2016)、骨格形成や変形性関節症におけるHYBID(HYaluronan-Binding protein Involved in hyaluronan Depolymerization)を介した新規ヒアルロン分解系の役割(Am J Pathol, 187:1162, 2017; Am J Pathol, 188:2109, 2018)を報告し(図1)、プロテアーゼを介した組織内微小環境因子代謝が腫瘍形成・進展や炎症性疾患発症に深く関与していることを明らかにしてきました。現在、これらの研究成果を基に、企業と共同でADAM28を標的とした肺がん分子標的医薬の開発を進めるとともに、遺伝子改変マウスなどを用いて病的組織における組織内微小環境因子代謝メカニズムの解明に取り組んでいます。
Tissue microenvironmental factors are composed of extracellular matrices and various bioactive factors. They are known to play a crucial role in maintenance of tissue homeostasis and dysregulation of these factors is involved in tissue destruction and contributes to the pathogenesis of various diseases. We investigated the significance of tissue microenvironmental factors modulated by metalloproteinases such as ADAMs (a disintegrin and metalloproteinases) and MMPs (matrix metalloproteinases) during tumor progression. In human lung and breast carcinomas, we have shown that ADAM28 is overexpressed predominantly by carcinoma cells and its expression correlates with lymph node metastasis (Int J Cancer, 118:263, 2006). Mechanistically, ADAM28 promotes cell proliferation by re-activation of insulin-like growth factor-1 through digestion of IGF-binding protein-3 as well as enhances tumor metastasis by promoting P-selectin glycoprotein ligand-1/P-selectin-mediated tumor cell rolling adhesion to endothelial cells and by escaping from von Willebrand factor-induced apoptosis (Cancer Res, 66:9913, 2006; J Biol Chem, 282:25864, 2007; J Natl Cancer Inst, 104:906, 2012). We have further developed a human antibody against ADAM28 which could inhibit its activity in vivo, suggesting that this neutralizing antibody would be useful for treatment of cancer patients in the future. Dysregulation of tissue microenvironmental factors is also observed in non-cancerous diseases and we also investigated their roles under pathophysiological conditions such as aortic dissection (Atherosclerosis, 218:470, 2011; Circulation, 126:3070, 2012; Circ Res, 116:612, 2015), ulcerative colitis (EBioMedicine, 5:114, 2016), osteoarthritis (Am J Pathol, 188:2109, 2018), muscle regeneration (J Biol Chem, 290:28456, 2015) and endochondral ossification (Am J Pathol, 187:1162, 2017) (Figure 1). We are further investigating the mechanisms of tissue microenvironment establishment under various pathophysiological conditions, especially focusing on tumor development and gastrointestinal diseases.
2.がん間質細胞特性の解析研究
Clinicopathological and biological analysis of tumor stromal cells
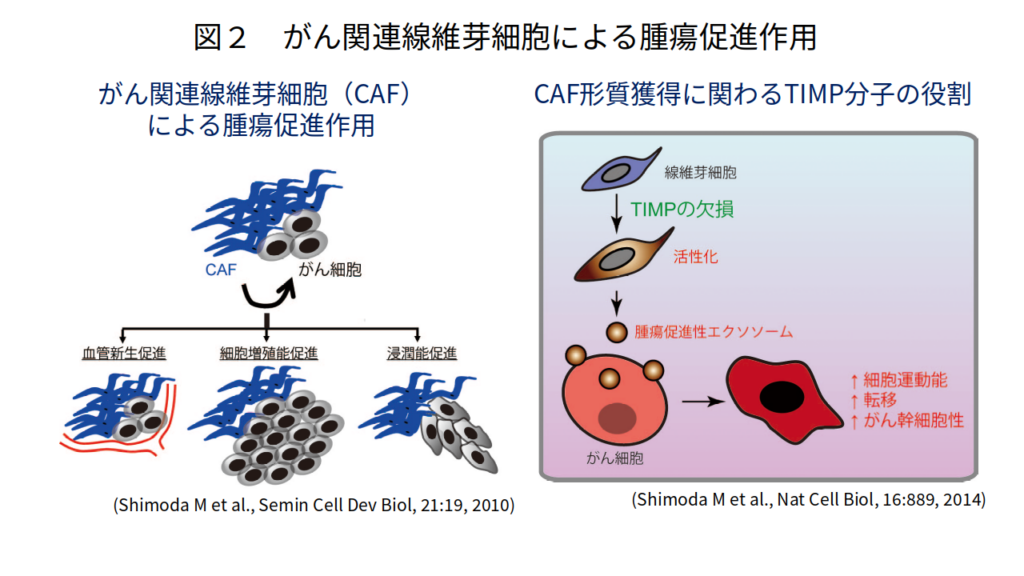
がん関連線維芽細胞(cancer-associated fibroblast: CAF)はがん間質の主要な構成成分であり、種々のがん組織において、CAFの存在ががんの悪性度と相関することが報告されています。また、がん細胞とCAFとの共培養やマウスへの移植モデルを用いた研究により、実験的にもCAFががん細胞の増殖・浸潤、がん幹細胞維持、血管新生などを促進することが実証されているほか(Semin Cell Dev Biol, 21:19, 2010)(図2)、最近の研究からCAFががん細胞の化学療法や放射線治療に対する抵抗性を強めることも明らかとなってきました。これらの研究からCAFはがんの新たな治療標的として注目されていますが、一方で、不均一な細胞集団であるCAFには複数のマーカーが報告されており(J Exp Med, 211:1503, 2014)、現在のところ治療標的とするべき特定のCAF細胞集団の同定やその制御機構についてはわかっていない部分が多く、CAFを標的とした治療薬の開発は進んでいないのが現状です。
近年我々はTIMP (tissue inhibitor of metalloproteinases)という分子がCAFの機能を抑制していることを明らかにしました。TIMPはメタロプロテアーゼの内因性阻害分子で、がん組織においてはメタロプロテアーゼとTIMPのバランスが崩れることにより腫瘍内微小環境が大きく変化することが知られています。この研究では、TIMP欠損線維芽細胞がメタロプロテアーゼ活性依存性に腫瘍促進性CAF形質を獲得することを見出しました。また、CAFががん細胞に作用する際の新たな細胞間コミュニケーション媒体としてエクソソーム(exosome)を同定し、線維芽細胞由来エクソソームががん細胞の運動能亢進やがん幹細胞維持に関与していることを報告しました(Nat Cell Biol, 16:889, 2014; Biochim Biophys Acta Mol Cell Res, 1864:1989, 2017)(図2)。最近がん間質における遺伝子発現パターンが独立した予後予測因子となりうることが報告され、がん間質からのシグナルが直接的あるいは間接的にがん細胞に影響を及ぼし、腫瘍の進展に積極的に関与していることが推測されています。また、遺伝的異常の頻度が高く、薬剤耐性を獲得しやすいがん細胞に比較して、間質を標的とした治療は治療抵抗性を生じにくいとも考えられます。現在、我々はオミックス解析技術などを取り入れ、治療標的となりうるCAF細胞集団の特性やがん細胞・免疫細胞との相互作用機序の解明に取り組み(Cancer Sci 111:727, 2020)、がん間質を標的とした新たな治療戦略確立を目指しています。
Tumors are complex tissues composed of carcinoma cells and surrounding stroma including various different types of mesenchymal cells and extracellular matrices. Carcinoma-associated fibroblasts (CAFs) are frequently observed in the stroma of human carcinomas and their presence in large numbers is often associated with the development of high-grade malignancies and poor prognoses (Semin Cell Dev Biol, 21:19, 2010) (Figure 2). CAFs are known to acquire activated phenotype and have been shown to stimulate tumor cell proliferation, elevate tumor cell invasion and boost angiogenesis by secreting various growth factors and cytokines. Although it is conceivable to therapeutically target CAFs to promote anti-tumor responses, CAFs are also thought to derive from multiple origins and make up a heterogeneous population of cells (J Exp Med, 211:1503, 2014). Thus it is an important question to understand the unique roles of the different subpopulations of CAFs. We have recently generated quadruple Timp (tissue inhibitor of metalloproteinases)-deficient fibroblasts to unleash metalloproteinase activity within the tumor–stromal compartment and demonstrated that the complete loss of TIMPs allows the acquisition of hallmarks of CAF functions. Detailed analysis has revealed that increased metalloproteinase activity is involved in the induction of this activated fibroblast state and fibroblast-derived exosomes act as a tumor-promoting vector for stromal–cancer communication (Nat Cell Biol, 16:889, 2014; Biochim Biophys Acta Mol Cell Res, 1864:1989, 2017) (Figure 2). We are further evaluating various CAF cell lines by analyzing their clinicopathological and biological properties as well as gene expression patterns to sought to characterize functionally active CAFs. In this research project, we would like to contribute to the classification and precise molecular definition of subtypes of fibroblasts in tumor stroma, which may offer additional insights into CAF biology and inform clinical opportunities for new cancer therapies.